El analista aplica conocimientos físicos, químicos,matemáticos e informáticos para resolver problemas analíticos.
1 DEFINICIÓN DEL PROBLEMA ANALÍTICO:
Encontraremos un problema analítico siempre y cuando sea necesario conocer la composición, estructura o propiedades de un sistema material.
Por ejemplo:
Evaluación de la calidad del aire de una ciudad. Podemos preguntarnos si el aire de una ciudad es de buena calidad. Para dar respuesta a estas cuestiones debemos de formularlas como problemas analíticos. ¿Cuál es la concentración de SO2, NOx y partículas en suspensión en el aire de la ciudad?
La respuesta a estas cuestiones analíticas nos servirá para resolver el problema original. En campos tan dispares como el medioambiental, la industria, la salud y la sociedad.
2. ELECCIÓN DEL MÉTODO:
Una vez definido el problema analítico,bien sea: medioambiental, industrial, sanitario o social debemos de responder una serie de cuestiones antes de elegir el método más adecuado para el análisis.
a) LOS ANALÍTICOS DE INTERÉS:
Debemos de establecer que analito nos ayudarán a resolver el problema planteado. Podemos determinar elementos o compuestos, sustancias inorgánicas u orgánicas; incluso el mismo elemento en los mismos estados de oxidación.
b) IDENTIFICAR O CUANTIFICAR:
En la mayoría de los casos quizás sólo sea necesario identificar la sustancia, pero también nos puede interesar conocer su concentración.
c) ESTADO FÍSICO DE LA MUESTRA:
Los analitos forman parte de sistemas materiales que pueden encontrarse en cualquiera de los estados de agregación. El estado físico de la muestra condiciona el procedimiento seguido para la determinación del analito. Aunque se determine la misma sustancia,el estado físico de la muestra influirá tanto en el tratamiento,como en la elección de la mejor técnica de análisis para obtener buenos resultados analíticos.
d) EXACTITUD Y PRECISIÓN:
Si los resultados analíticos requieren de gran exactitud y precisión el esfuerzo para obtenerlos será mayor y, consecuentemente el coste de los análisis también. El analista repite varias veces la misma medida sobre una muestra y con frecuencia se obtienen valores individuales ligeramente diferentes. Consideramos como mejor resultado la media aritmética de los resultados analíticos al repetir N veces una media experimental sobre la misma muestra.
Se define la exactitud como el grado de concordancia entre el resultado del análisis Xmedia y valor verdadero o aceptado de la concentración del analito en la muestra inicial analizada. La media aritmética coincide con el valor verdadero cunado no existe error sintemático. La diferencia entre el resultado analítico obtenido y el valor verdadero se conoce como sesgo.
Al realizar repetidamente la misma medida sobre una muestra nos encontramos con que los valores obtenidos pueden ser mas o menos dispersos. Se define como precisión como grado de concordancia entre dos o mas medidas que se han hecho exactamente de la misma manera. El parámetro estadístico que nos indica la precisión es la desviación estándar.
Se conoce como repetibilidad como la precisión de una serie de medidas obtenidas en un corto periodo de tiempo y de forma idéntica. Si existiese alguna modificación, analista, muestra, equipo o laboratorio hablamos de reproductibilidad.
E) CANTIDAD DE MUESTRA DISPONIBLE:
La cantidad de muestra disponible nos limitará el número de análisis que podemos realizar y minimiza la posibilidad de repetir la determinación en caso de error. Los métodos de análisis se clasifican en función del tamaño de la muestra en: macroanálisis, semimicroanálisis, microanálisis o ultramicroanálisis.
F) CONCENTRACIÓN DEL ANALITO EN LA MUESTRA:
Si los analitos se encuentran presentes en la muestra en u porcentaje mayor al 1%, se denominan macropotentes; entre el 1 - 0.01%, micropotentes y, en porcentajes inferiores al 0.01%, componentes trazas. En el caso de que los analitos aparecen en cantidades tan pequeñas, como unas pocas partes por millón, se clasifican como ultratrazas.
Cuando analizamos una muestra, debemos buscar el equilibrio entre la cantidad de muestra disponible y la concentración del analito de la misma, teniendo en cuenta cual es la cantidad mínima necesaria para obtener una señal analitica medible. Los métodos analiticos presentan limitaciones en su capacidad para detectar la presencia de un analito en una muestra y para su cuantificación; así se define el límite de detección como la mínima cantidad del analito que proporciona una señal significativamente diferente de la señal del blanco y el límite de cuantificación como la mínima concentración del analito que se puede medir con cierta fiabilidad. La presencia de un analito en una muestra se puede establecer con seguridad pero no su ausencia, debido a que se puede encontrar a un nivel de concentración inferior del que el método de análisis puede detectar. La capacidad de un método analitico para detectar o determinar concentraciones semejantes del analito en la muestra se conoce como sensibilidad.
G) RECUPERACIÓN DE LA MUESTRA TRAS EL ANÁLISIS:
Cuando la muestra para analizar es valiosa o el esfuerzo para conseguirla a sido elevado, es conveniente conservarla: lo que no llevará a escoger métodos no destructivos.
H) BIBLIOGRAFÍA:
Es conveniente consultar los metodos oficiales de análisis, muchas veces publicados en documentos legislativos como el BOE o los Métodos Normalizados de Análisis de organizaciones, como ISO, UNE o ASTM, o consular en libros especializados sobre química analítica o revistar científicas como Chemical Abstracts.
I) INTERFERENCIAS:
Las sustancias interferentes son las que producen respuesta en el equipo de medida del mismo modo que el analito. Para eliminarlas se aplican métodos de separación como la extracción, la precipitación, la destilación, o la cromatografía. Decimos que un método analítico es selectivo cuando es capaz de generar resultados que dependen solo del analito.
J) EL FACTOR TIEMPO:
Cuando existe la posibilidad de degradación o pérdida del analito, el analista debe aplicar técnicas de conservación de la muestra. La necesidad de un análisis rápido puede ser tan alta que podemos desplazar los instrumente del análisis al lugar donde se encuentra la muestra, " análisis in situ". El conocimiento del sistema material que se está analizando y su posible evolución deben ser evaluados por el analista para tomar una decisión sobre la rapidez con la que se realiza el análisis.
K) LOS RECURSOS MATERIALES:
Todo análisis se verá limitado por las herramientas de las que disponga el analista, equipos, reactivo, material e instalaciones y su disponibilidad en el momento necesario.
L) LA EXPERIENCIA DEL ANALISTA:
Siempre que sea posible la aplicación de un método analítico conocido será más fácil obtener mejores resultados.
3. OBTENCIÓN DE LA MUESTRA
La información analítica extraída de una pequeña porción del material debe ser representativa de todo el conjunto, así la muestra tomada debe tener la misma composición que el resto del material. Lo ideal sería muestrear un material homogéneo (situación poco común). En un sistema material homogéneo cualquier porción que se tome tendrá la misma composición y será representativa del conjunto. Los gases son capaces de mezclarse con mayor facilidad que los líquidos y sólidos constituyendo sistemas más homogéneos. Los sólidos presentan mayor heterogeneridad.
Podemos tomar muestras en sistemas materiales en los tres estados de agregación, analtos de naturaleza orgánica o inorgánica con propiedades físicas y químicas diferentes como la solubilidad, volatilidad, reactividad, estabilidad y toxicidad entre otras. La elección de las herramientas, medios de conservación y medidas de seguridad más adecuadas minimizará el riesgo de pérdida o transformación del analíto
4. PREPARACIÓN DE LA MUESTRA
La muestra debe de transformarse para convertirla en una muestra medible de la que podamos extraer la información analítica, pocas veces es posible analizar la muestra inmediatamente después de su llegada al laboratorio sin someterla a un tratamiento previo. Se deben realizar operaciones de separación ya que los analitos de interés se encuentran en una matriz más o menos compleja de la que debemos separarlos para poder medirlos.
Los sólidos se secan, trituran, tamizan y mezclan para lograr mahhr homogeneidad. Cuando se quieren eliminar las impurezas se pueden cristalizar si son solubles. La mayoría de los métodos de análisis exigen que la muestra se encuentre disuelta, muchas sustancias son solubles en agua o disolventes orgánicos pero a veces es necesario disgregarla, tratándola con reactivos químicos, ácidos, bases u oxidantes, aplicando energía en forma de calor o radiación.
Los analitos de interés de un sólido se pueden recuperar aplicando técnicas de extracción sólido - líquido. Otras técnicas como la decantación, filtración y la centrifuagación se aplican para eliminar los sólidos que contiene un líquido. La extracción líquido - líquido nos permitirá recuperar un analito de una muestra líquida. Los gases se absorben en líquidos o adsorben sobre sólidos para su posterior análisis.
5.MEDIDA DE LA PROPIEDAD
Una vez acondicionada la muestra se procede a su análisis. la medida de una propiedad físicoquímica nos dará la respuesta de que analitos y en que cantidad se encuentran en la muestra problema. Esta propiedad varía de manera conocida con la concentración del analíto. La aplicación de los métodos instrumentales comporta la preparación de una serie de patrones de las que mediremos la misma propiedad físicoquímica que a la muestra problema obteniendo una relación proporcional entre la concentración y la señal del instrumento. Finalmente la medida de la señal de la muestra problema nos servirá para obtener los resultados analíticos.
6. TRATAMIENTO DE DATOS
Una vez obtenida la señal analítica debemos realizar cálculos para conocer la concentración del analito en la muestra original, poniendo atención en los pasos seguidos en para conseguirla.
Se acepta como resultado analítico la media aritmética de los valores obtenidos en los análisis y debe ir acompañado su intervalo de confianza.
IC= x±Δ
Los límites de confianza son los valores superior e inferior del intervalo y nos delimitan el conjunto de valores donde podemos encontrar el valor real con una probabilidad previamente establecida.
El cálculo del intervalo de confianza se realiza a partir de la desviación estándar y la utilización de unas tablas de probabilidad aplicando la ecuación:
Δ= t.s / √N
t: t de Student
s: desviación estándar
N: número de medidas
Con el cuadro que podemos ver a continuación se puede determinar la t
Si aumenta el número de medidas, el intervalo de confianza es menor pero esto supone un mayor esfuerzo. Debemos encontrar el equilibrio entre la estrechez del intervalo de confianza aceptado y la cantidad de determinaciones que estamos dispuestos a realizar.
7. INFORME ANALÍTICO
El cliente no necesariamente tiene conocimientos de química, por ello se recomienda realizar un informe de los resultados analíticos completos y sencillo a la vez. Se suele informar de la presencia o ausencia del analito en la muestra, de su cantidad absoluta o más comúnmente relativa expresada en unidades de concentración (%), molaridad, ppm, etc. Si existe alguna regulación legal del analito analizado o un intervalo aceptado donde su concentración se considere normal, es conveniente proporcionar también este dato.
Es un informe de un análisis clínico es de mucha utilidad conocer si el parámetro analítico se encuentra dentro de los niveles considerados normales. Un operario puede interpretar si el proceso funciona correctamente y si se encuentra dentro de las especificaciones.




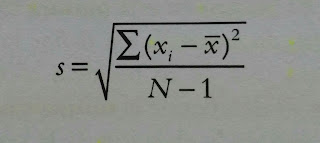



Felicitaciones, Infinitamente agradecido. Me sirve mucho. Gracias.
ResponderEliminarPodrian resumir un poco mas el contenido?
ResponderEliminar